MET基因突变是肺癌少见突变之一,包括MET14跳跃突变(3%)及MET扩增(1%)。2020年5月7日,美国FDA基于GEOMETRY mono-1研究结果批准了诺华制药的小分子MET抑制剂卡马替尼(卡帕替尼,INC280,商品名Tabrecta)上市,用于治疗携带MET基因外显子14跳跃突变的晚期NSCLC。
【通用名】:capmatinib 卡马替尼 卡帕替尼
【商品名】:Tabrecta
【规格】:150mg;200mg
【生产企业】:卢修斯GMP
根据是否存在导致肿瘤或血浆标本中MET外显子14跳跃的突变,选择接受TABRECTA治疗的患者。如果在血浆标本中未检测到导致MET外显子14跳跃的突变,则在可行的情况下检测肿瘤组织。
建议用量
TABRECTA的推荐剂量为400 mg,口服,每日两次,与食物同服或不与食物同服。
将TABRECTA片剂整粒吞下。请勿打碎、压碎或咀嚼药片。
如果患者错过或呕吐了某个剂量,则指示患者不要补足剂量,而是在计划时间服用下一个剂量。
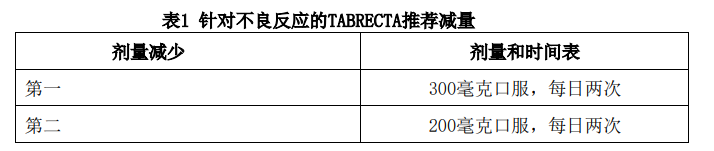
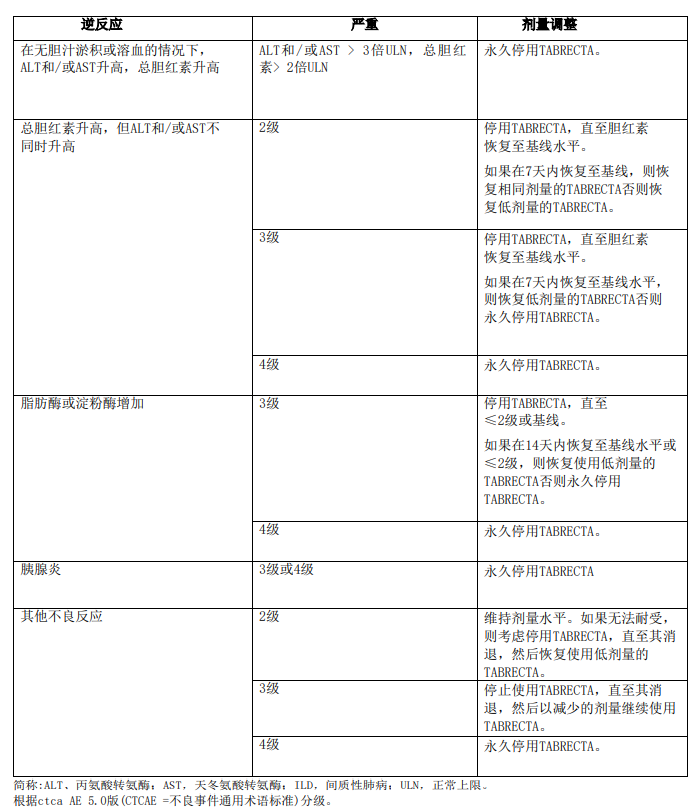
不良反应剂量调整
表1列出了管理不良反应的建议剂量减少量。
对于无法耐受每日两次200 mg口服给药的患者,永久停用TABRECTA。表2提供了针对不良反应的TABRECTA推荐剂量调整方案。
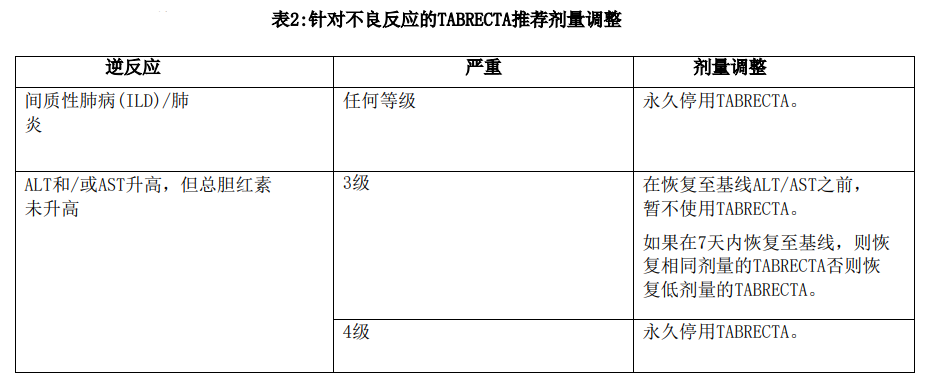
接受TABRECTA治疗的患者发生了ILD/肺炎,可能导致死亡。
监测是否出现指示ILD/肺炎的新的或恶化的肺部症状(如呼吸困难、咳嗽、发热)。对于疑似ILD/肺炎患者,立即停用TABRECTA,如果未发现ILD/肺炎的其他潜在原因,则永久停用。
肝中毒
使用TABRECTA治疗的患者出现肝毒性。
开始TABRECTA治疗前监测肝功能检测(包括ALT、AST和总胆红素),在前3个月治疗期间每2周监测一次,之后每月监测一次或根据临床指示监测,转氨酶或胆红素升高的患者更频繁地进行检测。根据不良反应的严重程度,停用、减少剂量或永久停用TABRECTA。
胰腺毒性
接受TABRECTA治疗的患者出现淀粉酶和脂肪酶水平升高。
在基线时和TABRECTA治疗期间定期监测淀粉酶和脂肪酶。根据药物不良反应的严重程度,临时停用、减少剂量或永久停用TABRECTA。
光敏风险
根据动物研究的结果,TABRECTA存在光敏反应的潜在风险。
在GEOMETRY mono-1中,建议患者在使用TABRECTA治疗期间采取预防紫外线暴露的措施,例如使用防晒霜或防护服。建议患者在使用TABRECTA治疗期间限制直接紫外线暴露。
胚胎-胎儿毒性
根据动物研究的结果及其作用机制,当对孕妇使用TABRECTA时,可能会对胎儿造成伤害。
告知有生育能力的女性在使用TABRECTA治疗期间和末次给药后1周内使用有效避孕方法。建议有生育能力的女性性伴侣的男性在使用TABRECTA治疗期间和最后一次给药后1周内使用有效避孕方法。
 药之友
药之友